Агентство ведет свою историю от Закона о чистых продуктах питания и лекарствах 1906 года, который был создан для пресечения злоупотреблений со стороны производителей потребительских товаров. В 1930 году она была официально переименована в Управление по контролю за продуктами и лекарствами.
Fda что это за организация

Многие производители хотели бы предложить свою продукцию на американском рынке, поскольку там есть аудитория, которая достойно платит и может многократно увеличить ожидаемые доходы. Но даже первый поиск в Google показывает, что главным препятствием для выхода на рынок США является одобрение FDA.
В сегодняшней статье мы поговорим о том, что такое FDA, что оно контролирует и рассмотрим некоторые конкретные продукты, которые FDA «одобряет» или «не одобряет».
Что такое FDA и как она работает?
Управление по контролю за продуктами и лекарствами (FDA) или Управление по контролю за продуктами и лекарствами — это агентство Министерства здравоохранения и социальных служб США, одного из федеральных департаментов исполнительной власти.
Она регулирует качество продуктов питания, лекарств, косметики, табачных изделий и некоторых других категорий товаров и обеспечивает соблюдение законов и стандартов в этих областях.
FDA — старейшее агентство по комплексной защите прав потребителей в США. Хотя FDA стало известно под своим нынешним названием только в 1930 году, его современная регулирующая роль началась с Закона о чистых продуктах питания и лекарствах 1906 года, который запретил межгосударственную торговлю фальсифицированными продуктами и поддельными лекарствами.
С тех пор FDA менялось вместе с социальными, экономическими, политическими и правовыми изменениями в США. Изучение истории этих изменений проливает свет на изменение роли FDA в укреплении здоровья населения и предлагает уроки, которые следует учитывать при оценке современных проблем регулирования.
FDA описывает свою миссию следующим образом:
Ответственность за охрану здоровья населения,
Обеспечение безопасности и эффективности лекарств, ветеринарных препаратов, биологических продуктов и медицинских изделий
Обеспечение безопасности пищевых продуктов и косметики.
FDA также отвечает за регулирование производства, маркетинга и распространения табачных изделий с целью защиты здоровья населения и сокращения потребления табака несовершеннолетними.
FDA отвечает за улучшение здоровья населения путем содействия ускорению инноваций для создания более эффективных, безопасных и доступных медицинских товаров.
Что регулирует FDA?
Полномочия FDA в области регулирования очень широки. Его обязанности тесно перекликаются с обязанностями многих других государственных учреждений. Производители часто испытывают разочарование и растерянность, когда речь заходит о поиске подходящего регулирующего органа. Ниже приведен список традиционно признанных категорий продуктов, которые подпадают под юрисдикцию FDA.
В целом, FDA регулирует:
Продукты питания, в том числе:
Другие продукты питания (хотя USDA имеет приоритет в регулировании определенных продуктов из мяса, птицы и яиц).
Продукты питания, в том числе:
Рецептурные препараты (фирменные названия и дженерики),
Нерецептурные препараты.
Биологические препараты, в том числе:
Вакцины для людей,
кровь и продукты крови,
продукты клеточной и генной терапии,
Ткани и ткани,
Медицинские изделия, в том числе:
передовые технологии, такие как кардиостимуляторы,
хирургические имплантаты и протезы.
Электронные изделия, излучающие радиацию, в том числе:
Устройства для ультразвуковой терапии,
Косметика, в том числе:
Цветовые добавки, содержащиеся в косметике и других средствах личной гигиены,
увлажняющие и очищающие средства для кожи,
Ветеринарные препараты, в том числе:
Корм для животных,
корма для животных,
ветеринарные препараты и устройства.
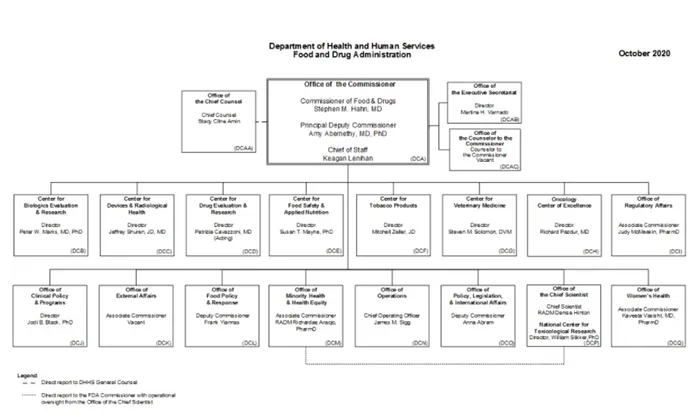
В рамках FDA существует несколько агентств, которые регулируют тот или иной продукт, подлежащий проверке FDA. К ним относятся:
Центр оценки и исследования биологических препаратов,
Центр по приборам и радиологическому здоровью,
Центр по оценке и исследованию лекарств,
Центр безопасности пищевых продуктов и прикладного питания,
Центр табачных изделий; и Центр ветеринарной медицины,
Центр ветеринарной медицины,
Национальный центр токсикологических исследований,
Бюро уголовных расследований,
Управление по нормативно-правовому регулированию.
Агентство ведет свою историю от Закона о чистых продуктах питания и лекарствах 1906 года, который был создан для пресечения злоупотреблений со стороны производителей потребительских товаров. В 1930 году она была официально переименована в Управление по контролю за продуктами и лекарствами.
Что означает «одобрено FDA»?
Одобрение FDA Одобрение FDA означает, что «преимущества продукта при правильном использовании перевешивают известные риски». Чтобы получить такое разрешение, производители должны заполнить форму предварительного разрешения (PMA) и приложить результаты клинических испытаний.
Чтобы принять решение об одобрении использования продукта или лекарства, FDA должно решить, перевешивает ли польза от его применения риски. FDA обычно одобряет продукт с высоким риском, если его использование принесет значительную пользу — как в случае со спасающим жизнь искусственным сердечным клапаном.
Какая продукция должна получать одобрение от FDA?
В США разрешение обычно требуется для рекламы и продажи продуктов, которые представляют серьезный риск в виде травм или заболеваний, но при этом обещают пользу для здоровья — например, рецептурные препараты, безрецептурные препараты, вакцины и медицинские приборы класса III.
FDA делит медицинские изделия на три класса — класс I, II и III. Составные медицинские изделия, которые имплантируются в тело, поддерживают жизнь или потенциально могут вызвать травму или заболевание, относятся к классу III. К ним относятся имплантируемые кардиостимуляторы, замена сердечных клапанов и даже грудные имплантаты.
Устройства низкого риска, используемые вне тела — презервативы, инвалидные коляски с электроприводом, бинты — относятся к категориям II и I. Например, приложение ЭКГ для Apple Watch относится к категории II.
Что означает «разрешено FDA»?
Медицинские устройства классов I и II обычно «одобряются» FDA, если производитель может доказать, что его устройство «по существу эквивалентно другому аналогичному и законно рекламируемому» устройству, которое уже было одобрено или разрешено FDA. Такие уже одобренные продукты называются предикторами.
Допустим, Samsung хочет разработать приложение, которое записывает одноканальную ЭКГ — то, что уже умеет делать приложение Apple. Затем компания могла бы получить одобрение FDA, сравнив свой продукт с продуктом Apple и доказав, что они безопасны, эффективны и по сути эквивалентны.
Компании должны подать заявку 510(k), называемую предварительным уведомлением, в FDA, чтобы Управление по контролю за продуктами и лекарствами рассмотрело продукт и одобрило его использование. Как только FDA объявляет, что новый медицинский продукт по существу эквивалентен базовому продукту, он считается «одобренным» и может быть представлен и продан в США.
Процесс производства таких препаратов более длительный и сложный. Это увеличивает производственные затраты и создает довольно высокий барьер для входа на этот рынок, который могут позволить себе только крупные компании.
FDA: Наша главная задача – это здоровье и безопасность населения

Современный рынок перегружен множеством различных продуктов и услуг, и область эстетической медицины не является исключением. При таком наплыве продуктов и лекарств необходим строгий и постоянный контроль качества, который осуществляют специализированные организации.
Их цель — обеспечить, чтобы на рынке не было опасных продуктов, которые могут угрожать здоровью или жизни пациента. FDA — агентство Министерства здравоохранения и социальных служб США, подробнее о котором вы можете прочитать в этой статье на estet-portal.com.
Главные особенности контроля за качеством продуктов и медикаментов в США
FDA (Food and Drug Administration) — это агентство по контролю качества продуктов питания и лекарств в США. Репутация этого факультета неоспорима во всем мире.
Любой профессионал в области эстетической медицины знает, что продукт или медицинское устройство, одобренное FDA, обязательно высокого качества.
FDA осуществляет надзор за качеством продуктов питания, лекарств, косметики, медицинских приборов и табачных изделий. Важно знать, что FDA также следит за соблюдением всех законов и стандартов в этой области.
История контроля за качеством продукции и медикаментов в США

Оно было основано в 1906 году под названием «Бюро химии». Деятельность FDA в области контроля за продуктами и лекарствами началась с Закона о чистых продуктах и лекарствах, который запрещал торговлю поддельными или некачественными продуктами. В 1931 году название агентства было изменено на нынешнее Управление по контролю за продуктами питания и лекарствами.
Поскольку FDA является правительственным агентством, глава агентства назначается президентом США и утверждается Сенатом.
Главные функции организации по контролю за качеством FDA
FDA отвечает за защиту здоровья населения путем обеспечения эффективности и безопасности лекарств, биологических продуктов и медицинских приборов.
Также FDA:
- Обеспечивает безопасность продуктов питания и лекарств,
- отвечает за регулирование производства и продажи табачных изделий,
- Его миссия заключается в укреплении здоровья населения путем содействия ускорению инноваций, которые делают медицинские товары более эффективными, безопасными и доступными.
Основная миссия FDA заключается в обеспечении здоровья и безопасности населения.
Будущее контроля за качеством продукции и медикаментов
В то время, когда расходы на здравоохранение стремительно растут, требования к качеству продукции становятся все более жесткими.
Для доказательства безопасности и эффективности лекарств необходимы крупномасштабные рандомизированные клинические испытания.
Однако многие ученые утверждают, что текущие исследования лишь определяют, лучше ли одно лечение, чем другое. Поэтому для многих практикующих врачей будущее за персонализированной медициной, которая, несомненно, требует гораздо более тщательного подхода.
Прелесть работы маркетолога в том, что у вас всегда есть свобода выбора. Только вы решаете, акции какой компании вы хотите купить, и только от вас зависит, какую прибыль вы сможете обеспечить.
Основной документ FDA для медицинских аппаратов – 510( k)
Большинство разрешений FDA, о которых говорят производители медицинского косметического или пластического хирургического оборудования, — это документы, которые FDA выдает производителям оборудования в рамках процесса 510(k). В этом документе всегда упоминаются эквиваленты устройства, назначение устройства и показания к применению. Чем больше претензий хочет предъявить производитель, тем больше досье ему приходится составлять и тем больше денег тратить на адвокатов. На рынке США это важно, поскольку показания к применению регулируются страховыми компаниями. Врач, который лечит заболевание с помощью определенного продукта, должен сначала использовать продукт, который обозначен с таким показанием в ответе на предварительное уведомление FDA, или доказать, что он использовал этот продукт, потому что не мог использовать его надлежащим образом, и что продукт имеет назначение, соответствующее лечению данного заболевания. Производителям выгодно добавлять показания для своего продукта, если он используется для лечения этих показаний в системе медицинского страхования, но, как упоминалось выше, процесс 510(k) является дорогостоящим и становится тем дороже, чем больше показаний. В качестве примера того, как компании получают одобрения на основе бизнес-целей, можно привести два примера.
Пример 1. Компания Solta Medical однажды расширила показания к применению лазера Fraxel re:store DUAL, включив в них актинический кератоз, предраковое состояние кожи, которое лечится по медицинскому страхованию в США, чтобы успешно продвигать и продавать Fraxel клиникам, которые лечат актинический кератоз, что является очень большим рынком в США.
Пример 2 — прибор и наконечник ResurFX с длиной волны 1565 нм, который показан для: — Используется в дерматологических процедурах, требующих фракционной регенерации кожи и коагуляции мягких тканей. Такая формула означает, что ResurXF может использоваться во всех случаях, когда врач считает необходимым «фракционное изменение формы кожи», т.е. лечение морщин, рубцов, постакне, растяжек, выравнивание текстуры кожи и т.д. Производитель аппарата M22 не счел нужным доказывать FDA, что его фракционный лазер может использоваться для определенных показаний, таких как лечение мелких морщин, растяжек или рубцов после акне, поскольку это не нужно и слишком дорого.
Что касается модуля ResurFX аппарата M22, стоит отметить, что за пределами США компания Lumenis делает следующие заявления: «Лазер ResurFX™ 1565 нм показан для использования в дерматологических процедурах: Коагуляция мягких тканей Процедуры шлифовки кожи Лечение стрий Лечение дисхромии, включая, но не ограничиваясь этим: Лентигины Мелазма Лечение: Периферические морщины Рубцы от акне Хирургические рубцы. Интересно, что аналогами ResurFX являются вышеупомянутый Fraxel, а также лазер Palomar Lux1540.
Из этих примеров ясно, что показания, перечисленные в уведомлении 510(k), не отражают напрямую характеристики медицинского изделия. В них говорится только о том, как производитель намерен продвигать свой продукт на рынке США и какие усилия (время и деньги) он приложил, чтобы закрепиться на американском рынке. Американским производителям и компаниям, нацеленным на рынок США, как правило, легче получить такие «показания, одобренные FDA», поскольку процесс 510(k) проще для американских производителей. Наконец, есть много компаний, которые не собираются выходить на рынок США, потому что не могут, например, компании, находящиеся под санкциями, или не хотят, потому что сосредоточены на своем местном рынке; у таких компаний нет «одобрения FDA» и не должно быть.
Получение одобрения De Novo
В некоторых случаях производитель хочет продавать в США медицинское изделие, аналогов которому не существует. Это либо продукт с совершенно новым способом действия, либо с совершенно новыми показаниями. В этих случаях классифицировать продукт невозможно, и производитель обращается в FDA в рамках отдельной процедуры, называемой регистрацией de novo. Это гораздо более длительный и сложный процесс, требующий от производителя представления другого файла 510(k), но в отсутствие других вариантов регистрация de novo также существует на рынке эстетических медицинских изделий. Например, компания De Novo в свое время получила одобрение на препарат Zeltiq, поскольку на рынке США не было аналогов. Когда продукт получает такое разрешение, он автоматически попадает в третью — самую опасную — категорию, поскольку о нем еще мало что известно и он считается опасным во всех отношениях. Поэтому компания должна дополнительно представить обширные научные и клинические данные, демонстрирующие безопасность, чтобы FDA отнесло ее ко второй категории. Компании, получившие одобрение de novo, являются лидерами рынка, которые первыми выходят на рынок и таким образом добиваются увеличения продаж, а также прокладывают путь для других компаний, поскольку остальным необходимо доказать эквивалентность с лидером рынка.
По данным FDA, мы приближаемся к медицинским устройствам категории 3 — это самые потенциально опасные устройства, работа которых может нанести значительный ущерб здоровью или привести к смерти. Это, например, кардиостимуляторы. Чтобы получить такое разрешение, производитель медицинского изделия должен представить обширные данные исследований, собранные в течение многих лет (доклинические исследования, клинические испытания фаз I, II и III). Для рассмотрения досье, составленного самим производителем, FDA требуется не 90 дней, как в случае с 510(k), а 180 дней, при этом инспекции завода FDA являются обязательными. Считается, что PMA в три раза дороже, чем предварительное уведомление 510(k), но именно по этому пути должны идти производители медицинского оборудования, если предполагаемое использование и показания попадают в категорию 3. Таким образом, если вы хотите продавать имплантируемые кардиостимуляторы в США, вы сможете сделать это только в том случае, если получите предварительное разрешение на продажу.
К счастью, устройства, используемые в дерматологии, косметологии и пластической хирургии, не попадают в категорию 3 FDA. Например, чисто хирургическое устройство VASER, предназначенное для липосакции и липоскульптуры, классифицируется как устройство категории 2. Интересно, что термин premarket approval означает предварительное одобрение на рынке. Утверждениеа термин Premarket Notification переводится как предпродажное уведомление. Уведомлениено продавцы всех устройств в России называют предварительное маркетинговое уведомление одобрением FDA в рамках процесса 510(k). Успешное получение разрешения 510(k) также часто называют одобрением FDA или допуском FDA.
Почему наличие одобрения FDA – это хорошо?
Почти все крупные производители медицинского оборудования мечтают выйти на рынок США, поскольку этот рынок огромен и очень привлекателен, несмотря на сильную конкуренцию. Однако одобрение FDA требует денег и времени, а также строгого соблюдения многочисленных требований со стороны производителя. Например, вы не можете производить медицинское устройство в своем гараже; вам необходимо сертифицированное FDA производственное предприятие. Вы не сможете получить одобрение FDA класса 2, не продемонстрировав безопасность и эффективность продукта и не представив высококачественные клинические данные. Одобренный FDA косметический продукт показывает, что он одобрен для продажи в США и, следовательно, является безопасным и эффективным; это также свидетельствует о том, что производитель данного продукта располагает ресурсами для получения такого одобрения.
Производитель, представивший свое медицинское устройство в рамках процесса 510(k), несет ответственность за все, что связано с его продуктом. Если данные в документации были неверными или сфальсифицированными, что в конечном итоге привело к проблемам у пациента, производитель рискует не только запретом на продажу медицинского изделия, но и ответственностью перед пациентом.
Если в рекламе какого-либо устройства вы видите фразу «одобрено FDA», это хорошо — это косвенно подтверждает его эффективность и безопасность. Однако отсутствие такого одобрения не обязательно означает, что устройство неэффективно и небезопасно, оно просто означает, что оно не продается в США. Всегда уточняйте у дистрибьютора наличие одобрения FDA, если оно указано. Это простой документ в формате pdf, размещенный на сайте агентства и доступный у поставщика. В большинстве случаев эти документы можно найти в разделе 510(k).
Интерпол, Всемирная таможенная организация, Постоянный форум по борьбе с международной наркопреступностью, Целевая группа медицинских руководителей, правоохранительные органы, Институт безопасности наркотиков и Европол провели операцию «Пангея V».
Как отзывает FDA
Отзыв — это изъятие или исправление продукта из-за проблем, которые нарушают закон и поэтому могут преследоваться FDA. Отзыв может быть инициирован самой компанией, по просьбе FDA или по требованию FDA. Хотя FDA имеет право отзывать биологические продукты (продукты, изготовленные из человеческих клеток или тканей, например, вакцины), устройства и детские молочные смеси, оно не имеет права приказывать или требовать отзыва лекарств.
«Количество отозванных лекарств, одобренных FDA, неуклонно растет. В 2015 году было отозвано более 4 600 лекарств и устройств, 405 из которых могли привести к серьезному вреду или смерти.»
В случае с медицинскими изделиями отзыв обычно является добровольным со стороны производителя. В редких случаях, когда производитель или импортер не может отозвать продукт, представляющий риск для здоровья, FDA может отдать распоряжение об отзыве. Производители могут рассылать письма врачам, чтобы проинформировать их, но пациенты не получают такого письма.
Прежде чем FDA примет решение о выдаче производителю уведомления об отзыве, оно рассматривает несколько факторов, а группа экспертов оценивает имеющиеся данные о безопасности и эффективности.
Комитет классифицирует отзыв как отзыв категории I, II или III, при этом категория I является наиболее серьезной. Отзыв категории I может привести к серьезным травмам или смерти.
Как финансируется FDA
Финансирование FDA испытаний лекарств является постоянным источником споров. В 1992 году Конгресс принял Закон о сборе за использование рецептурных препаратов (PDUFA). PDUFA позволило FDA взимать плату с производителей лекарств для ускорения процесса утверждения. В настоящее время около двух третей средств на утверждение лекарств поступает от фармацевтических компаний.
По данным Проекта государственного надзора, в 2015 году FDA потратило около 1,1 миллиарда долларов на рассмотрение заявок на рецептурные препараты. 29% этих денег поступило от Конгресса. Это означает, что налогоплательщики профинансировали $331,6 млн, а львиную долю — $769,1 млн — внесли фармацевтические компании.
Хотя это облегчает бремя налогоплательщиков, некоторые наблюдатели считают, что эти расходы могут быть переложены на потребителей в виде роста цен на лекарства.
Что еще более важно, FDA может быстрее утверждать препараты под влиянием фармацевтических компаний в ущерб общественной безопасности, сказал Майкл А. Каром, директор исследовательской группы Public Citizen по вопросам здравоохранения.
Отчет о нежелательных событиях
После того как лекарство, медицинское устройство или вакцина поступили в продажу, FDA полагается на добровольные отчеты производителей, больниц, врачей и пациентов, чтобы отслеживать нежелательные явления или осложнения, связанные с этими продуктами. Когда производитель получает сообщение о неблагоприятном событии, он должен направить эту информацию в FDA.
FAERS, MAUDE и VAERT Для сбора данных о неблагоприятных событиях FDA использует Систему сообщений о неблагоприятных событиях (FAERS) для лекарственных препаратов, Систему взаимодействия производителей и пользователей (MAUDE) для медицинских приборов и Систему сообщений о неблагоприятных событиях, связанных с вакцинами (VAERS), для вакцин. Агентство использует эти данные для определения необходимости принятия регулирующих мер в отношении продукта, который может быть опасен для населения.
Регуляторные действия включают: обновление этикетки безопасности, ограничение использования лекарства или устройства, обмен информацией о безопасности с общественностью или отзыв продукта с рынка. FDA редко требует отзыва продукции.
Данные FAERS, MAUDE и VAERS имеют свои ограничения, согласно FDA. Например, поскольку отчетность является добровольной, может быть больше инцидентов, чем известно агентству. Также нет гарантии, что неблагоприятное событие напрямую связано с лекарством, устройством или вакциной.
На платформе R StocksTrader, например, можно использовать кредитное плечо 1:4 для позиций овернайт. Таким образом, рентабельность можно смело умножать в 4 раза. Сразу возникает вопрос, в чем подвох и почему еще не все биржевые трейдеры стали миллионерами.
Роль Food and Drug Administration в выборе компании
FDA играет важную роль в анализе компаний и определении потенциального роста цен на акции.
На этапе утверждения 95% компаний будут работать в убыток, поэтому анализ их финансового положения не принесет никакой пользы.
Однако информация о заявке на IND в FDA, которую можно посмотреть на сайте агентства www.fda.gov, должна привлечь ваше внимание, поскольку акции таких компаний могут очень быстро вырасти в цене после одобрения.
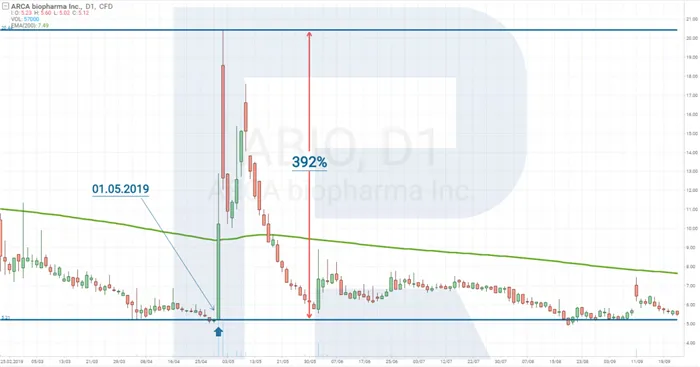
В качестве простого примера, биотехнологическая компания ARCA biopharma, Inc ( NASDAQ: ABIO ) опубликовала результаты 2-й фазы испытаний Genetic-AF 1 мая 2019 года.
После этой новости акции ARCA Biopharmaceuticals выросли на 392% за два дня.
Ускоренная процедура одобрения FDA
Чтобы определить, насколько вероятно, что препарат будет одобрен FDA, необходимо протестировать сам препарат. Процесс ускоренного утверждения FDA был введен в 1992 году и применяется к препаратам, которые лечат смертельные заболевания и для которых в мире нет аналогов. Биотехнологические компании поняли, что таким образом они с большей вероятностью получат одобрение и окупят затраты на разработку, поэтому они все чаще нацеливаются на трудноизлечимые заболевания.
Благодаря ускоренному процессу утверждения на рынок вышли лекарства от СПИДа и других трудноизлечимых заболеваний.
Так, если в заявке указано лекарство, аналогов которого в мире не существует, и которое будет использоваться, например, для лечения рака, существует очень высокая вероятность того, что это лекарство появится на рынке, и акции компании «взлетят».
Инвестиции в ETF
Помимо краткосрочной выгоды, акции сектора здравоохранения также могут быть хорошей долгосрочной инвестицией, особенно во время кризиса.
Люди всегда болеют, независимо от того, есть кризис или нет, и им всегда нужно лечение, а это значит, что прибыль фармацевтических компаний, имеющих на рынке хотя бы несколько лучших лекарств, будет расти.
Конечно, не все так просто, как кажется, ведь в этом случае необходимо проанализировать финансовое положение компании, а также количество продаваемых препаратов, когда истекает срок действия патента и многое другое. В этом случае кажется, что гораздо проще заработать 300% за несколько дней, чем выбрать компанию, акции которой будут расти в течение нескольких лет.
Но не отчаивайтесь, вы можете довериться профессионалам и купить биржевой фонд (ETF). В этом случае вы покупаете целую отрасль или определенную группу акций и страхуетесь от провала определенных компаний на рынке.
Например, биржевой фонд сектора здравоохранения под кодовым названием XLV, торгуемый на Нью-Йоркской фондовой бирже, с 2008 года вырос почти на 500%. Аналогичным образом, биржевой фонд биотехнологического сектора, торгуемый на NASDAQ под кодовым названием IBB, с 2008 года принес 650% прибыли.
Она регулирует качество продуктов питания, лекарств, косметики, табачных изделий и некоторых других категорий товаров и обеспечивает соблюдение законов и стандартов в этих областях.
Что такое FDA?
FDA (USFDA) — это федеральное агентство США (входит в состав Министерства здравоохранения и социального обеспечения), которое следит за качеством и безопасностью продукции. Агентство исследует безопасность продуктов питания, табака, лекарств, косметики, диетических добавок, медицинских приборов и оборудования для ухода за собой. FDA также пропагандирует здоровый образ жизни в США и постепенно становится глобальной. За его деятельностью и результатами следят не только американцы, ведь стандарты качества этого агентства считаются самыми строгими, поэтому одобрение продукта FDA сразу же повышает его популярность и доверие покупателей во всем мире.
Некоторые виды медицинского и косметического оборудования, например, лазеры, проходят только клинические испытания FDA. Поскольку испытания могут занимать несколько лет (даже десятилетий), FDA может со временем отозвать свое разрешение, если в ходе испытаний выяснится, что продукт потенциально вреден для пользователя. По этой причине FDA может предоставить статус «регулируемого» в дополнение к статусу «одобренного».
FDA-approved и FDA-regulated — есть ли разница?
Сертификат качества FDA гарантирует безопасность продукта в соответствии с максимальным перечнем критериев. Однако в случае косметики и косметических продуктов (немедицинских продуктов) статус «одобрено» может быть присвоен только после того, как продукт был выпущен на рынок. Затем крем, сыворотка или косметическое средство тестируется на наличие нежелательных побочных эффектов у пользователей. Любой пользователь, столкнувшийся с неблагоприятной реакцией (например, аллергической реакцией на крем) при использовании продукта, может заполнить онлайн-отчет на сайте ведомства. Таким образом, Орган собирает огромное количество данных, которые при анализе могут выявить эффекты, частота которых выше среднестатистической вероятности.
Важно также знать, что стандарты качества для лекарственных препаратов и косметики отличаются. Закон определяет принадлежность продукта к той или иной категории, принимая во внимание тип использования и цель, для которой он предназначен. Однако это не мешает некоторым производителям продавать лекарства под видом косметики и, наоборот, классифицировать косметические составы как лекарства.
Что гарантирует сертификат FDA?
Прежде всего, такой сертификат гарантирует безопасность состава продукта — ни один ингредиент не может быть вреден для человека. Исследуются технологические, химические и микробиологические свойства, а также радиоактивная безопасность продукта. Наличие сертификата позволяет выйти на рынок не только в США, но и в более чем десяти странах, которые считают сертификат FDA статусным (в том числе в Австралии, Канаде и т.д.).
Упаковка также важна для сертификации: название бренда, полная информация о производителе, состав, срок годности, рекомендации по применению и хранению. Пользователь должен получить наиболее полную и четкую информацию о продукте, изучив маркировку на упаковке.
Для клиентов сертификат от самого строгого органа в мире является гарантией личной безопасности, укрепляя доверие не только к практикующему врачу и процедуре, но и к учреждению.
Для салонов красоты и медицинских центров использование сертифицированного оборудования, косметики и материалов — это способ поддержания не только высоких внутренних стандартов качества, но и престижа в глазах клиентов. Для категории премиум это очень важно.
Давайте подытожим — почему наличие сертификата FDA крайне желательно для косметологического оборудования:
- Повышается доверие клиентов — они с большей вероятностью будут покупать процедуры, увеличивается число повторных клиентов,
- гарантия безопасности — FDA является исследовательской организацией, которая проводит клинические испытания,
- это возможность для производителей закрепиться на международном рынке (особенно в США, Австралии и Канаде),
- Сертифицированное оборудование отличает салон от «соседей» и является непременным условием конкурентоспособности в категории премиум-класса.
Одновременное наличие сертификатов международного образца позволяет салону выделиться на фоне более слабых конкурентов и позиционировать себя в восприятии клиентов как заведение премиум-класса, предлагающее только безопасные и качественные процедуры. Это не только улучшает поток клиентов и повышает их лояльность к вам, но и облегчает переход новых посетителей в категорию постоянных. А постоянные клиенты — это источник постоянного дохода.
Поэтому сертификация оборудования и материалов напрямую связана с качеством предоставляемых вами услуг и, следовательно, с выгодой, которую получает компания.